যৌগ গঠনের সময় অষ্টক নিয়ম ও দুই-এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে দ্রাব্যতা এবং বিদ্যুৎ পরিবাহিতা।
প্রাকৃতিক গ্যাসের প্রধান উপাদান মিথেন এবং খাবার লবণ মূলত সােডিয়াম ক্লোরাইড। খাবার লবণের পানিতে দ্রবণীয়তা এবং দ্রবণের বিদ্যুৎ পরিবাহিতা পরীক্ষা কর। এই যৌগ দুইটি গঠনের সময় ইলেকট্রন আদান-প্রদান অথবা শেয়ার করে। যৌগ গঠনের সময় মৌলসমূহ অষ্টক নিয়ম অথবা (এবং) দুই-এর নিয়ম অনুসরণ করে। যৌগ দুইটি গঠনের সময় অষ্টক নিয়ম ও দুই-এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে দ্রাব্যতা এবং বিদ্যুৎ পরিবাহিতা সংক্রান্ত প্রতিবেদন প্রণয়ন।
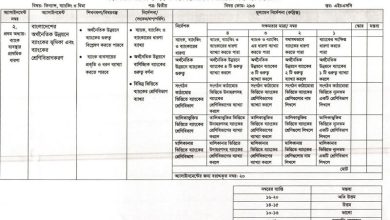
নির্দেশনা (সংকেত/ধাপ/পরিধি):
১. অষ্টক ও দুই-এর নিয়ম লিখতে হবে।
২. সমযােজী বন্ধন গঠন প্রক্রিয়া ও দ্রবণীয়তা লিখতে হবে।
৩. আয়নিক বন্ধন গঠন প্রক্রিয়া ও দ্রবণীয়তা লিখতে হবে।
৪. যৌগের বিদ্যুৎ পরিবাহিতা লিখতে হবে।
প্রদত্ত যৌগ দুইটি গঠনের সময় অষ্টক নিয়ম গু দুই এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে দ্রাব্যতা এবং বিদ্যুৎ পরিবাহিতা সংক্রান্ত প্রতিবেদন।
তারিখঃ (জমাদানের তারিখ)
প্রধান শিক্ষক, … ….উচ্চ বিদ্যালয়,
এপার নাহ. ..(জেলারনাম)।
বিষয়ঃ প্রদত্ত যৌগ দুইটি গঠনের সময় অষ্টক নিয়ম গু দুই এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে দ্রাব্যতা এবং বিদ্যুৎ পরিবাহিতা সংক্রান্ত প্রতিবেদন।
মহোদয়,
বিনীত নিবেদন এই যে, গণপ্রজাতন্ত্রী বাংলাদেশ সরকার, মাধ্যমিক ও উচ্চ শিক্ষা অধিদপ্তর, বাংলাদেশ, ঢাকা- এর স্মারক নং-৩৭.০২.০০০.১০৬.২৭(অংশ-১).০০১.২০-৯৯৮, তাং ০৬-০৯-২০২১ শ্রীঃ মোতাবেক রসায়ন আ্যাসাইনমেন্ট নং-০১ এর “প্রদত্ত যৌগ দুইটি গঠনের সময় অষ্টক নিয়ম ও দুই-এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে ড্রাব্যতা এবং বিদ্যুৎ পরিবাহিতা” সংক্রান্ত বিষয়ে আমার প্রনয়নকৃত প্রতিবেদন নিম্নরুপঃ
১. অষ্টক ও দুই-এর নিয়ম:
অষ্টক নিয়মঃ বিভিন্ন মৌলের পরমাণুসমূহ নিজেদের মধ্যে ইলেকট্রন আদান-প্রদান এবং শেয়ারের মাধ্যমে পরমাণুসমূহের শেষ শক্তিস্তরে যে আটটি ইলেকট্রনের বিন্যাস লাভ করে তাকে অষ্টক নিয়ম বলে।
যেমন, সোডিয়াম ক্লোরাইড (NaCl) গঠনের সময় সোডিয়াম পরমাণু একটি ইলেকট্রন ত্যাগ করে এবং ক্লোরিন পরমাণু ঐ ইলেকট্রন গ্রহণ করে। এভাবেই, উভয় মৌলের পরমাণুই সর্ববহিঃস্থ স্তরে অষ্টক কাঠামো লাভ করে।
অষ্টক নিয়মের সাহায্যে বেশিরভাগ যৌগের বন্ধন ব্যাখ্যা করা যায়। মৌলসমূহ অষ্টক পূর্ণ করার জন্যই রাসায়নিক বন্ধনে অংশ নেয়।
দুই এর নিয়মঃ প্রতিটি মৌল তার সর্বশেষ শক্তিস্তরে নিকটতম নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জন করে স্থিতিশীলতা লাভ করতে চাই।
অণু গঠনকালে প্রতিটি মৌল তার সর্বশেষ শক্তিস্তরে ইলেকট্রন গ্রহণ, বর্জন বা শেয়ারের মাধ্যমে অষ্টক পূর্ণ করে। একে অষ্টক নিয়ম বলে। কিন্তু অনেক পরমাণু, অনু গঠনকালে অষ্টক নিয়মের ব্যতিক্রম দেখায়।
এ কারণে বিজ্ঞানীরা দুই এর নিয়ম উপস্থাপন করেন। দুই এর নিয়ম অষ্টক নিয়ম থেকে অধিকতর উপযোগী এবং আধুনিক।
অনু গঠনে কোন পরমাণুর সর্বশেষ শক্তিস্তরে এক বা একাধিক জোড়া ইলেকট্রন বিদ্যমান থাকবে। এটি দুই এর নিয়ম। অর্থাৎ অণুতে যেকোন পরমাণুর সর্বশেষ শক্তিস্তরে এক বা একাধিক জোড়া ইলেকট্রন অবস্থান করবে
CH₄ অনুর কেন্দ্রীয় পরমাণু C এর সর্বশেষ শক্তিস্তরে চার জোড়া অর্থাৎ আটটি ইলেকট্রন বিদ্যমান। আবার প্রতিটি H এর শক্তিস্তরে একজোড়া করে অর্থাৎ দুটি ইলেকট্রন বিদ্যমান।
NaCl এর অষ্টক নিয়মের চিত্রসহ ব্যাখ্যাঃ
এখানে, Na শেষ কক্ষপথের একটি e ত্যাগ করে শেষ ৮টি e লাভের মাধ্যমে স্থিতিশীলতা অর্জন করে এবং Cl ১টি ইলেক্ট্রন গ্রহণের মাধ্যমে শেষ কক্ষপথে ৮টি e লাভ করে।
সুতরাং, Na3Cl উভয়ের ক্ষেত্রে অষ্টক নিয়ম হয়েছে।
CH4 অনুর অষ্টক ও দুই এর নিয়ম এর চিত্রসহ ব্যাখ্যাঃ
এখানে, কার্বনের শেষ কক্ষপথের চারটি ইলেকট্রন রয়েছে। সুতরাং, C এ ক্ষেত্রে অষ্টক নিয়ম ঘটেছে। আর চারটি H এর ক্ষেত্রে শেষ কক্ষপথের দুটি করে e- বিদ্যমান। সুতরাং H এর ক্ষেত্রে দুই এর নিয়ম ঘটেছে।
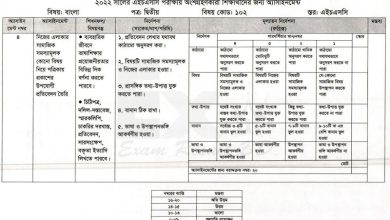
২. সমযােজী বন্ধন গঠন প্রক্রিয়া ও দ্রবণীয়তা
সমযোজী বন্ধনঃ অনু গঠনের সময় দুটি পরমানু নিজ নিজ বহি:স্তরে নিস্ক্রিয় গ্যাসের স্থিতিশীল ইলেকট্রন কাঠামো অর্জনের উদ্দেশ্যে যদি সমান সংখ্যক অযুগল ইলেকট্রন সরবরাহ করে এক বা একাধিক ইলেকট্রন জোড় সৃষ্টি করে এবং উভয় পরমানু তা সমানভাবে শেয়ার করে, তবে পরমানুদ্বয়ের মধ্যে যে বন্ধন গঠিত হয়, তাকে সমযোজী বন্ধন বলে।
CH4 এর গঠন:
সাধারণত অধাতু- অধাতু যে বন্ধন এর মাধ্যমে একে অপরের সাথে সংযুক্ত হয় তাহলে সমযোজী বন্ধন। এ বন্ধন এর ক্ষেত্রে e শেয়ার করার মাধ্যমে স্থিতিশীলতা অর্জিত হয়।
৪টি H পরমাণুর চারটি e, c এর বহিঃস্থ চারটি e এর সাথে শেয়ার করে CH4 গঠনের মাধ্যমে C ও H স্থিতিশীলতা অর্জন করে। যেখানে C ও H এরমধ্যে শেয়ারিং এর মাধ্যমে বন্ধন হওয়ায় এ ধরনের বন্ধনকে সমযোজী বন্ধন বলে।
CH4 এর দ্রবণীয়তা:
আমরা জানি CH4 একটি অপোলার সমযোজী যৌগ। আবার বেশির ভাগ ও পোলার সমযোজী যৌগ পানির সাথে মিশেনা। মিথেন গ্যাসকে পানিতে দ্রবীভূত করতে চাইলে পানিতে সৃষ্ট আংশিক ধনাত্মক প্রান্ত (HS+) এবং ঋনাত্মক প্রান্ত (OS2-) কে আকর্ষণ করে না। তাই মিথেন পানিতে দ্রবীভূত হয়না।
৩. আয়নিক বন্ধন গঠন প্রক্রিয়া ও দ্রবণীয়তা
ক্যাটায়ন (ধনাত্মক আয়ন) এবং অ্যানায়নসমূহ (ঋণাত্মক আয়ন) যে আকর্ষণ বল দ্বারা যৌগের অণুতে আবদ্ধ থাকে তাকে আয়নিক বন্ধন বলে।
নিচে NaCl এর গঠন এর চিত্র দেওয়া হলোঃ
সোডিয়াম পরমাণুর ইলেকট্রন বিন্যাস হচ্ছে [(2, 8, 1) বা 1s2 2s 2 2p 6 3s1 ] নিষ্ক্রিয় মৌল নিয়ন (Ne) অপেক্ষা এ পরমাণুতে একটি ইলেকট্রন বেশি থাকে। এ অতিরিক্ত ইলেকট্রনটি ত্যাগ করে সোডিয়াম পরমাণু নিয়নের মত ইলেকট্রন বিন্যাস পেতে চায়।
আবার ক্লোরিন পরমাণুর ইলেকট্রন বিন্যাস হচ্ছে (2, 8, 7) বা (1s2 2s2 2p6 3s2 3p5)নিষ্ক্রিয় মৌল আর্গন (Ar) অপেক্ষা এ পরমাণুতে একটি ইলেকট্রন কম থাকে। কোন মৌল থেকে এটি একটি ইলেকট্রন গ্রহণ করে আর্গনের মত ইলেকট্রন বিন্যাস (1s2 2s2 2p6 3s2 3p6) পেতে চায়।
ফলে সোডিয়াম পরমাণু এবং ক্লোরিন পরমাণু পরস্পরের সংস্পর্শে এলে সোডিয়াম পরমাণু একটি ইলেকট্রন ত্যাগ করে এবং ক্লোরিন পরমাণু ঐ ইলেকট্রনটি গ্রহণ করে একটি ইলেকট্রন ত্যাগ করে সোডিয়াম, Na + আয়নে পরিণত হয় এবং একটি ইলেকট্রন গ্রহণ করে ক্লোরিন CI^- আয়নে পরিণত হয়।
তারপর Na-1 ও Cl- এর মধ্যে বন্ধন সৃষ্টি হয়। নিচে তা দেখানো হলো
এভাবে আয়নিক বন্ধনের মাধ্যমে NaCI গঠিত হয়।
NaCI এর দ্রবণীয়তাঃ
এটি একটি আয়নিক যৌগ। আমরা জানি, আয়নিক যৌগ পানিতে দ্রবীভূত হয়। NaCl পানিতে দ্রবীভূত হওয়ার ক্ষেত্রে Na+ আয়ন পানির ঋনাত্মক O2- আয়ন কে এবং Cl– আয়ন পানির ঋনাত্মক H+ আয়ন কে আকর্ষণ করে। এভাবে পানিতে এর এরা দ্রবীভূত হয়।
নিচে তার চিত্র দেওয়া হল:
ঘ) যৌগের বিদ্যুৎ পরিবাহিতাঃ
বিদ্যুৎ পরিবাহিতাঃ
আমরা জানি, বিদ্যুৎ প্রবাহ মানে ইলেকট্রন প্রবাহ। অর্থাৎ ইলেকট্রনের প্রবাহ হলে বিদ্যুৎপ্রবাহ হবে। কোন যৌগ যদি বিদ্যুৎ পরিবর্তন করতে চায় তার ইলেকট্রনের প্রবাহ প্রয়োজন হয়। আর তার জন্য যৌগের মুক্ত ইলেকট্রন থাকতে হয়।
অর্থাৎ, কোন যৌগের মুক্ত ইলেকট্রন থাকলে বিদ্যুৎ পরিবহন করবে অন্যথায় করবে না। NaCl বিগলিত থাকা অবস্থায় তার মধ্যে মুক্ত ইলেকট্রন বিদ্যমান থাকে। তাই NaCl বিগলিত অবস্থায় বিদ্যুৎ পরিবহন করে।
অন্যদিকে ও পোলার সমযোজী CH4 এর ক্ষেত্রে মুক্ত ইলেকট্রন থাকে না। যার কারণে মিথেন বিদ্যুৎ পরিবহন করে না।
নিচে এদের চিত্র দেয়া হলোঃ